黑色素瘤是由黑色素细胞恶变引起的、最具侵袭性的皮肤恶性肿瘤之一,发病呈逐年上升趋势[1]。尽管黑色素瘤的治疗方法很多,但预后仍然较差。因此探究黑色素瘤发展机制,挖掘出相应的药物治疗靶标,对于开发有效的治疗黑色素瘤药物,提高黑素瘤临床疗效至关重要。
前B细胞白血病同源盒基因(PBX1)是调控多种生物过程的重要转录因子。近年来,越来越多的证据表明PBX1的失调与肿瘤的发生、不良预后和耐药有关[2]。研究发现PBX1在黑素瘤细胞中表达增加,过表达PBX1可显著促进黑素瘤细胞生长[3]。然而,PBX1对黑色素瘤的临床影响以及PBX1在黑色素瘤发生、发展中的分子机制尚不清楚。
近日,金沙2004路线js5刘晋宇教授、中国医科大学的高兴华教授及金沙2004路线js5第二医院高洪文教授作为共同通讯作者,联合在Signal Transduction and Targeted Therapy (IF =38)杂志上发表了题目为“G-quadruplexes folding mediates downregulation of PBX1 expression in melanoma”的研究论文。该研究发现靶向PBX1启动子和转录本上特殊的、核酸二级结构的小分子化合物或反义寡核苷酸(ASO)可以有效抑制黑色素瘤的发展,提示PBX1可以作为全新的黑色素瘤治疗靶点,用于抗黑色素瘤药物的研发。
该团队首先发现PBX1在黑色素瘤组织中高表达,并且其高表达与黑色素瘤患者的不良预后显著正相关。体内、外功能实验研究发现:PBX1可以通过激活NF-κB信号通路,促进黑色素瘤的发展,表明PBX1在黑色素瘤中发挥癌基因的功能,并且可以作为黑色素瘤潜在的治疗靶点和预后标志物。
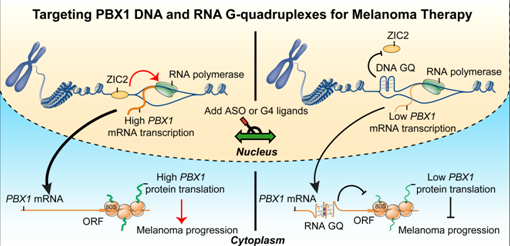
G-四链体结构(G4s)是在富含鸟嘌呤(G)的DNA或RNA链中形成的四链核酸结构,在调节DNA和RNA生物学过程中起着重要作用,并且G4s广泛存在于在人类癌基因的启动子区域和转录本中,正逐渐成为肿瘤病理生物学研究的热点和焦点。值得注意的是,PBX1的启动子和转录本中的G含量极其丰富,提示G4s可能在PBX1的启动子和转录本中形成,并参与调节PBX1的生物学功能,因此极有可能成为去拿新的开发抗肿瘤药物研发的重要靶标。
通过生物信息学和细胞生物学实验,课题组研究发现:黑色素瘤细胞中PBX1的启动子区和转录本中存在高度保守的G4s基序,且G4s形成会抑制PBX1的转录和翻译,显著减少PBX1蛋白的表达。进一步研究发现小分子化合物TMPyP4和PDS可以结合并稳定PBX1的G4s基序,显著抑制黑色素瘤细胞在体内外的生长和迁移(转移)。由于TMPyP4和PDS稳定PBX1转录本G4s基序特异较差,课题组设计出特异性靶向PBX1转录本G4s的ASO。该ASO可以特异性诱导PBX1转录本G4s的形成,显著抑制病人来源黑色素瘤异种移植模型中黑色素瘤的生长。上述这些重重要发现不但有助于深入解析黑色素瘤的致病机制,也为黑色素瘤预后判断以及靶向核酸高级结构抗癌药物的研发提供了新的线索和思路。博士研究生隋雨彤为本论文的第一作者。